INTRODUCCIÓN
El Blanqueamiento dental es un procedimiento químico que actúa sobre la estructura dentaria con el fin de mejorar la microestética, sin embargo, la interacción del agente blanqueador provoca efectos nocivos sobre la pulpa dental como sensibilidad, pulpitis reversible y muerte celular por necrosis1–4.
El peróxido de carbamida es un agente blanqueador que, al entrar en contacto con la saliva, descompone un 33% de su contenido en peróxido de hidrógeno, un agente oxidante que da lugar a especies de oxígeno reactivo (ROS) con la capacidad de degradar moléculas orgánicas complejas presentes en la estructura dental5,6. Además, el peróxido de carbamida libera urea, que se descompone en dióxido de carbono y amoníaco, sustancias que tienen propiedades proteolíticas que aumentan la eficacia del blanqueamiento dental6–9.
Sin embargo, las reacciones oxidativas y el daño celular provocado por los radicales libres, son los responsables de la toxicidad de los agentes blanqueadores10–12. El bajo peso molecular del Peróxido de Hidrógeno tiene la capacidad de difundirse a través del esmalte y dentina para alcanzar el espacio pulpar, dando lugar a efectos nocivos desde la reacción inflamatoria de la pulpa hasta extensas áreas de necrosis tisular, dependiendo de la concentración del agente blanqueador, el tiempo de aplicación, el calor, o si es un diente joven5,10,13.
Por tal motivo, esta investigación permitió valorar el nivel de Peróxido de Carbamida en sus diferentes concentraciones sobre la cámara pulpar, los resultados que se obtuvieron sirven como información científica y criterio clínico a considerar por los profesionales al realizar dicho procedimiento.
Materiales y métodos
Este estudio fue aprobado por el Subcomité de Ética de la Comisión de Investigación de Facultades de la Universidad Central del Ecuador con el código 0160-FO-G-2019.
Para este estudio, se utilizaron 120 terceros molares humanos extraídos, divididos aleatoriamente en cuatro grupos (n=30/grupo): grupo A: control; grupo B: 10% gel CP; grupo C: 20% gel CP y grupo D: 35% gel CP.
Fase de limpieza de la muestra
Las muestras fueron sometidos a un proceso de limpieza y eliminación de detritos utilizando una punta ultrasónica marca (Woodpecker, Londres, Inglaterra) para su posterior almacenamiento en solución salina al 0,9%, a temperatura ambiente para evitar la deshidratación. (Ver Figura 1)

Figura 1. Limpieza y eliminación de dentritos (Punta ultrasónica)
Para el experimento, las piezas dentales se cortaron 2 mm por debajo del límite amelocementario, este proceso se llevó a cabo con una máquina de corte Abrasive cut-off Wheels (BUEHLER LTD, Essligen, Alemania), con irrigación constante para evitar el sobrecalentamiento del diente. (Ver Figura 2)

Figura 2. Corte de la pieza dental con irrigación constante
Preparación de la muestra
La cavidad pulpar fue ampliada y preparada con la fresa endozeta (Maillefer, Suiza) hacia la pared lingual con el fin de establecer una estructura dental intacta de 2 mm de grosor que podría contener 40 mL de tampón de acetato, compuesto por ácido acético y acetato de sodio. Posteriormente, las fosas y fisuras oclusales fueron selladas con resina fluida (Filtek TM Z350XT, 3M ESPE, Saint Paul, USA) para evitar cualquier fuga del tampón fuera de la cavidad. Además, se colocó una etiqueta adhesiva circular de 5 mm de diámetro en el centro de la superficie labial. Luego, la porción restante del diente se pintó con esmalte de uñas gris (Nailwear pro, AVON, Quito, Ecuador) y después del secado se retiró la etiqueta adhesiva (eticoll, Girona, España), dejando un área de esmalte sin pintar de tamaño estándar para la aplicación del Blanqueamiento13. Después, se fabricó una plantilla de silicona de adición (elite HD+, Zhermack, Badia Polesine, Italia) colocando la superficie lingual en un ángulo de 30° desde la base. (Ver Figura 3)

Figura 1. Muestra preparada
Blanqueamiento
Se colocó sobre la cara vestibular de cada diente una capa continua (una gota) de Peróxido de Carbamida (Opalescence tooth whitening systems, Ultradent Products Inc., South Jordan, USA) al 10%, 20% y 35% en 30 dientes cada uno, por un tiempo de 40 minutos una sola vez. Además, se cubrió con una envoltura de polietileno de baja densidad lineal (embalajesterra, Valencia, España) para simular la colocación de una férula de acetato semirígido. Posteriormente, se colocó 40 µL de buffer de acetato (pH: 4,5) en la cavidad pulpar, esta solución tiene la capacidad de prevenir la degradación del peróxido hasta el momento del análisis. Al término de este tiempo se enjuagó las piezas dentarias con abundante agua13. Los dientes se mantuvieron a temperatura ambiente (25°C) durante el Blanqueamiento. (Ver Figura 4)
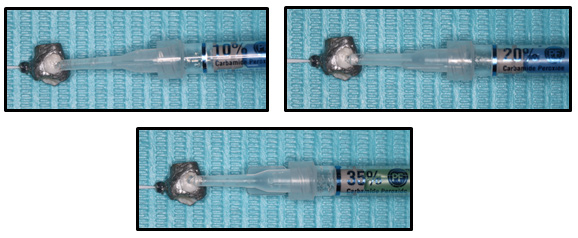
Figura 4. Colocación de Peróxido de Carbamida Opalescence tooth Whitening systems (Ultradent Products, Inc.) al a) 10%, b) 20% y c) 35% gel, 40 minutos cada uno.
Medición de penetración de CP a la cámara pulpar
Se elaboró una solución madre para las 120 muestras, que contenía: 1mL de tampón de acetato (pH: 4,5), 12,5 mL de solución de cristal violeta (0,0313 mg/ml), 25 mL de buffer de fosfato (pH: 6,17), y 12,5 mL de solución de peroxidasa de rábano picante (0,0625 mg/ml)13.
Para la medición de peróxido en la cámara pulpar se transfirió 10 µL recuperado de la cavidad pulpar a una celda que contenía 2,5 ml de buffer de fosfato y 0,5 ml de la solución madre (solución final)13. (Ver Figura 5)

Figura 5. Colocación de 10 µl de buffer de acetato de la cavidad a la solución final
Para realizar el proceso mencionado anteriormente, cada grupo de estudio se dividió en 10 subgrupos conformado por tres dientes para evitar la excesiva dilución de la solución madre, para cada muestra se realizó la medición en cuatro ocasiones por medio del espectrofotómetro, de la siguiente forma: se midió 4 veces la absorbancia inicial de la solución final sin buffer de la cavidad, después se colocó 10 µL de la cavidad del diente 1 y se midió 4 veces la absorbancia de dicho diente, luego se colocó 10 µL de la cavidad del diente 2 y se midió 4 veces la absorbancia de dicho diente, y finalmente se colocó 10 µL de la cavidad del diente 3 y se midió 4 veces la absorbancia de dicho diente, posteriormente se calculó el promedio de cada uno, y con estos valores se calculó los valores delta de absorbancia (ΔA) restado el factor de dilución13. Luego se realizó en otra celda el mismo proceso con los subgrupos restantes hasta completar las 30 muestras de cada grupo. (Ver Figura 6)
Figura 6. Colocación de la celda en el compartimento de muestras del Espectrofotómetro.
La intensidad de color se midió mediante un espectrofotómetro de absorbancia (CARY 50 BIO UV-VisiblE, VARIAN, Saumur, Francia) a una longitud de onda de 591 nm. Se usó una curva de calibración estándar con cantidades conocidas de peróxido para determinar la cantidad en miligramos equivalentes en las muestras. Empleando la curva de calibración se obtuvo una ecuación cuadrática de segundo grado, y dado que tuvo un coeficiente de determinación (R2) de 0,9843, se determinó las concentraciones aparentes en cámara pulpar. Donde la ecuación sería: 1,9089x2 -1,9898x + ΔA+ 0,023=0 (Ver Gráfico 1)
Los valores delta de absorbancia (ΔA) se reemplazaron en la ecuación, el resultado se multiplicó por cuatro, ya que en la cámara pulpar se colocó 40 uL en total. De esta manera se calculó la cantidad de peróxido de Carbamida que ingresó a la cámara pulpar.

Gráfico 1. Curva de calibración Calibration curve
Es importante recalcar que la oxidación del colorante no incidió en la absorbancia, para ello se realizaron varias diluciones, empleando violeta de genciana y peróxido, donde se puede determinar que, las variaciones son mínimas, y prácticamente constantes de una dilución a otra.
Barrido espectral: Cabe mencionar que, para conocer la longitud de onda máxima del presente estudio, se realizó un barrido en el espectro visible (400 nm a 800nm) con ayuda del Espectrofotómetro CARY 50 BIO UV-Visible (VARIAN, Francia) a la solución final.
Resultados
A partir de los datos experimentales, se organizó la información en una tabla de Excel, con estos valores se construyó una base de datos en SPSS versión 24 en español IBM ®, posteriormente se realizó la prueba de Normalidad de Kolmogorov-Smirnov donde los valores de significación (Sig) son superiores a 0,05 (95% de confiabilidad), por tanto, las muestras provienen de poblaciones con distribución normal, direccionando el análisis para las pruebas paramétricas: ANOVA, complementada con el test post Hoc de Tukey con una significancia del 95%.
Según los estadísticos descriptivos las medias obtenidas son: para el CP a 10%: 0,062 mg (±0,018), para el 20%: 0,063 mg (±0,017), y para el 35%: 0,086 mg (±0,024). (Ver gráfico 2)

Gráfico 2. Comparación de medias (mg)
De la prueba ANOVA, complementada con el test post Hoc de Tukey se determinó que el grupo control no detectó Peróxido de Carbamida en la cámara pulpar, por lo cual no fue tomado en cuenta. Sin embargo, los valores del grupo en que se empleó PC al 10% no difirió significativamente del grupo que se empleó el PC al 20%, pero estos grupos sí se diferenciaron del grupo en que se empleó la concentración del 35%. (Ver tabla 1)

Tabla 1. Pruebas post hoc (Prueba de Tukey)
Discusión
En la actualidad existe una gran demanda de Blanqueamientos dentales que mejoran la apariencia física de las personas, sin embargo, existen efectos nocivos sobre las estructuras dentales, especialmente sobre la pulpa dental, que está relacionada con la concentración del agente blanqueador y el tiempo de aplicación5,6,10,14, por lo cual el objetivo del presente estudio fue evaluar la penetración a la cámara pulpar del CP a diferentes concentraciones: 10%, 20% y 35%, con el fin de valorar el nivel de peróxido que atravesó al tejido pulpar. Se demostró que la penetración del CP en la cámara pulpar depende de su concentración.
Como se demuestra en la presente investigación, la penetración del CP en la cámara pulpar puede generar inflamación pulpar. De Oliveira y cols. (2014), mencionan acerca del intenso estrés oxidativo que provocan los geles blanqueadores, y frente a esto la incapacidad de los mecanismos de protección celular como la producción de enzimas antioxidantes para eliminar las ROS locales; y la lesión de la membrana celular provocada por la peroxidación lipídica, lo que genera la destrucción de la función celular y la muerte celular por necrosis. También, se activan enzimas proteolíticas presentes en la dentina, como catepsinas y metaloproteinasas, provocando la degradación de la matriz extracelular de la pulpa. Por tanto, dependiendo de la intensidad del daño celular y las alteraciones de la matriz extracelular, los efectos van desde la reacción inflamatoria de la pulpa hasta extensas áreas de necrosis tisular5.
De Oliveira y cols. (2014), demostraron que la baja toxicidad del Peróxido de Carbamida al 10% se relaciona con la menor difusión de peróxido a través de las estructuras dentales por lo que se considera la concentración más segura para el tejido pulpar5, coincidiendo con el presente estudio donde el Peróxido de Carbamida al 10% presentó menor penetración a la cámara pulpar.
Patri y cols. (2013), evaluaron la penetración del Peróxido de Carbamida al 10% en dientes restaurados, concluyeron que existe penetración del agente blanqueador a la cámara pulpar15, aunque el método presentado utilizó dientes intactos, se llegó a la misma conclusión.
La penetración del agente blanqueador parece independiente de la sustancia utilizada, Patri y cols. (2016) y Costa y cols. (2014) utilizaron como agente blanqueador el Peróxido de Hidrógeno al 30% y 38% respectivamente, concluyeron que sí existe difusión de peróxido a la cámara pulpar10,16. A pesar que utilizamos como agente blanqueador el Peróxido de Carbamida al 10%, 20% y 35% se obtuvo la misma conclusión; probablemente porque el CP se descompone en peróxido de hidrógeno, actuando de manera similar, por lo que es posible la penetración de peróxido a la cámara pulpar en las tres concentraciones evaluadas.
De Oliveira y cols. (2014) en su investigación analizaron la relación de la concentración del agente blanqueador con la difusión de peróxido, llegando a la conclusión que existe mayor difusión de Peróxido de Hidrógeno al 35% que el Peróxido de Carbamida al 10%5. En nuestro caso se utilizó como agente blanqueador el Peróxido de Carbamida al 10%, 20% y 35% obteniendo la misma conclusión, que a mayor concentración mayor penetración a la cámara pulpar.
Por otra parte, Marson y cols. (2015) determinaron que la penetración de Peróxido de Hidrógeno depende del tiempo de contacto del gel blanqueador con la estructura dental independientemente de la concentración del peróxido, dando como resultado que en concentraciones de Peróxido de Hidrógeno al 35% existió mayor penetración a la cámara pulpar que en concentraciones de Peróxido de Hidrógeno al 38% en 45 minutos17. En el presente estudio se afirma que la cantidad de difusión de peróxido a la cámara pulpar depende de su concentración aplicando el agente blanqueador 40 minutos; la variación de los datos obtenidos se puede deber a que los geles blanqueadores mantienen más del 86% de su concentración inicial de peróxido después de los 45 minutos, conservando así su capacidad de blanqueamiento17.
En cuanto al método para cuantificar peróxido en la cavidad pulpar, Gomes y cols. (2010) en su estudio utilizaron el propuesto por Bauminger18 y modificado por Hannig y cols. (19) que es un análisis espectrofotométrico basado en la reacción de 4-aminoantipirina y fenol con Peróxido de Hidrógeno catalizada por peroxidasa20. Además, Soares y cols. (2015) y Patri y cols. (2016) en sus investigaciones utilizan el método de Mottola que se basa en la reacción de Peróxido de Hidrógeno con leucocristal violeta catalizado por la enzima peroxidasa de rábano picante16,21. Sin embargo, en el presente estudio se realizó con el colorante cristal violeta y la enzima peroxidasa de rábano picante. A pesar de utilizar una metodología diferente se observó que existió reacción positiva del peróxido con la peroxidasa concluyendo en nuestro estudio que a mayor concentración del agente blanqueador mayor penetración al tejido pulpar.
Nuevos estudios deberán definir las concentraciones más seguras de agentes blanqueadores y el tiempo de utilización más inocuo para la pulpa dental, obteniendo resultados estáticos satisfactorios.
Conclusiones
De acuerdo a los resultados obtenidos en el estudio, concluimos que en los tratamientos de Blanqueamiento dental con Peróxido de Carbamida sí existe penetración de peróxido a la cámara pulpar, siendo mayor en el Peróxido de Carbamida al 35%, por lo que se acepta la hipótesis de investigación. Al comparar la cantidad de penetración del Peróxido de Carbamida al 10%, 20% y 35% a la cámara pulpar se concluye que a mayor concentración del peróxido mayor difusión a la cámara pulpar, siendo el Peróxido de Carbamida al 35% estadísticamente significativo.
Bibliografía
- Cedillo Orellana SI. Efectos del blanqueamiento dental sobre el tejido pulpar. 2016;1–46. Available from: http://dspace.ucuenca.edu.ec/handle/123456789/24808
- Cedeño J. Creencias y mitos del blanqueamiento dental en los habitantes de la parroquia San Mateo periodo 2016-2017. 2017;9:1–50.
- Batista G, Barcellos D, Torres C, Goto E, Pucci C, Borges A. The Influence of Chemical Activation on Tooth Bleaching Using 10% Carbamide Peroxide. Oper Dent [Internet]. 2011;36(2):162–8. Available from: http://www.jopdentonline.org/doi/10.2341/09-280-L
- Demarco FF, Meireles SS, Sarmento HR, Dantas RVF, Botero T, Tarquinio SBC. Erosion and abrasion on dental structures undergoing at-home bleaching. Clin Cosmet Investig Dent. 2011;3:45–52.
- de Oliveira Duque CC, Soares DG, Basso FG, Hebling J, de Souza Costa CA. Bleaching effectiveness, hydrogen peroxide diffusion, and cytotoxicity of a chemically activated bleaching gel. Clin Oral Investig. 2013;18(6):1631–7.
- Goldberg M, Grootveld M, Lynch E. Undesirable and adverse effects of tooth-whitening products: A review. Clin Oral Investig. 2010;14(1):1–10.
- Hyland BW, McDonald A, Lewis N, Tredwin C, Petrie A, Hall S, et al. A new three-component formulation for the efficient whitening of teeth (Carbamide Plus). Clin Oral Investig. 2014;19(6):1395–404.
- Borges B, Borges J, de Melo C, Pinheiro I, Santos A dos, Braz R, et al. Efficacy of a Novel At-home Bleaching Technique With Carbamide Peroxides Modified by CPP-ACP and Its Effect on the Microhardness of Bleached Enamel. Oper Dent [Internet]. 2011;36(5):521–8. Available from: http://www.jopdentonline.org/doi/10.2341/11-013-L
- Hirata R, Higashi C. Blanqueamiento dental: Concepto y sustancias blanqueadoras. Médica Pan. 2012. 385 p.
- Costa CAS, Riehl H, Kina JF, Sacono NT, Hebling J. Human pulp responses to in-office tooth bleaching. J Esthet Restor Dent [Internet]. 2014;26(5):356. Available from: http://dx.doi.org/10.1016/j.tripleo.2009.12.002
- Baxter R, Hastings N, Law A, Glass EJ. Blanqueamiento Dental. Anim Genet. 2008;39(5):561–3.
- Solís Cessa E. Aclaramiento dental: revisión de la literatura y presentación de un caso clínico. Dental clearance: review of the literature and case report. Rev ADM [Internet]. 2018;75(1):9–25. Available from: www.medigraphic.com/adm
- Kwon S, Pallavi F, Shi Y, Oyoyo U, Mohraz A, Li Y. Effect of Bleaching Gel Viscosity on Tooth Whitening Efficacy and Pulp Chamber Penetration: An In Vitro Study. Oper Dent [Internet]. 2018;43(3):326–34. Available from: http://www.jopdentonline.org/doi/10.2341/17-099-L
- Reis A, Kossatz S, Martins G, Loguercio A. Efficacy of and Effect on Tooth Sensitivity of In-office Bleaching Gel Concentrations: A Randomized Clinical Trial. Oper Dent [Internet]. 2013;38(4):386–93. Available from: http://www.jopdentonline.org/doi/10.2341/12-140-C
- Patri G, Agnihotri Y, Rao SR, Lakshmi N, Das S. An in Vitro Spectrophotometric Analysis of the Penetration of Bleaching Agent into the Pulp Chamber of Intact and Restored Teeth. 2013;7(12):3057–9.
- Patri G, Acharya G, Agrawal P, Panda V. Spectrophotometric evaluation of the pulpal peroxide levels in intact and restored teeth - An invitro study. J Clin Diagnostic Res. 2016;10(8):ZC44–7.
- Marson F, Goncalves R, Silva C, Cintra L, Pascotto R, Santos P, et al. Penetration of Hydrogen Peroxide and Degradation Rate of Different Bleaching Products. Oper Dent. 2015;72–9.
- Bauminger BB. Micro method for manual analysis of true glucose in plasma without deproteinization. 1974;1015–7.
- Hannig C, Za R, Henze E, Dreier S, Attin T. Peroxide release into saliva from five different home bleaching systems in vivo. 2005;18(1):15810475.
- Gomes CR, Wiegand A, Sener B, Attin T. Influence of chemical activation of a 35% hydrogen peroxide bleaching gel on its penetration and efficacy - In vitro study. J Dent [Internet]. 2010;38(10):838–46. Available from: http://dx.doi.org/10.1016/j.jdent.2010.07.002
- Soares DG, Gonçalves Basso F, Hebling J, De Souza Costa CA. Effect of hydrogen-peroxide-mediated oxidative stress on human dental pulp cells. J Dent. 2015;43(6):750–6.

Reconocimiento-NoComercial-CompartirIgual
CC BY-NC-SA
Esta licencia permite a otros entremezclar, ajustar y construir a partir de su obra con fines no comerciales, siempre y cuando le reconozcan la autorÍa y sus nuevas creaciones estÉn bajo una licencia con los mismos tÉrminos.











