Efecto de la irradiación con rayos gamma sobre la morfología de dos cultivares in vitro de malanga (Colocasia esculenta L. Schott)
Contenido principal del artículo
Resumen
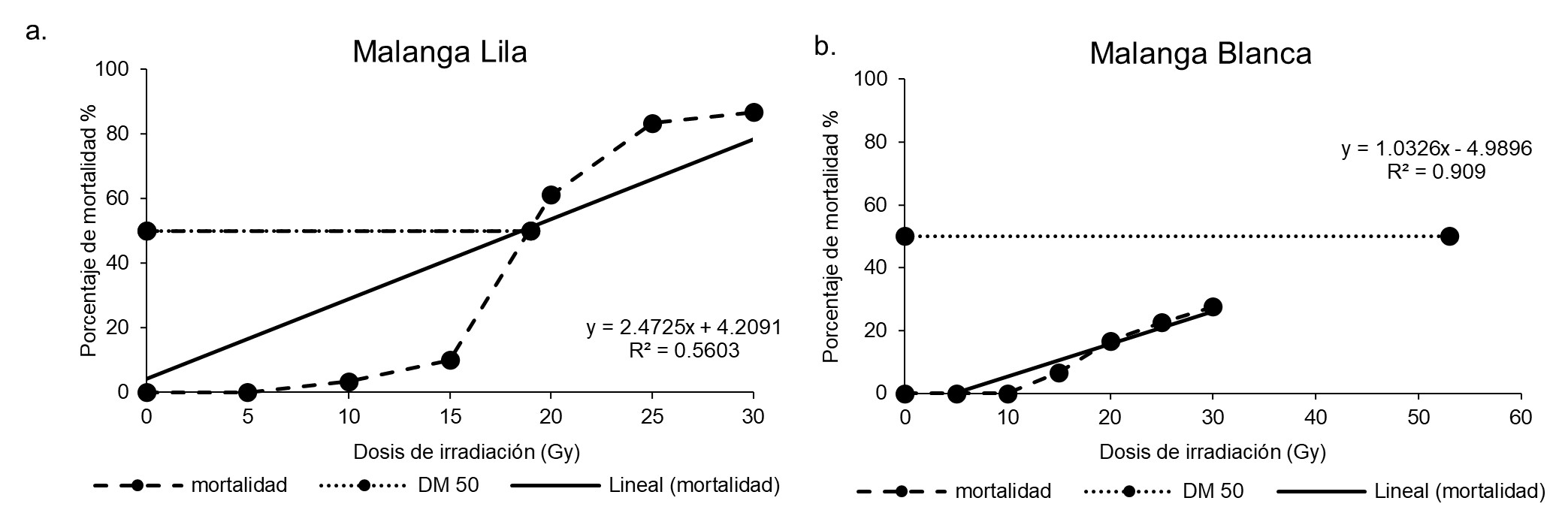
En Nicaragua se siembran dos cultivares de malanga (Lila y Blanca) (Colocasia esculenta L. Schott) ninguno tolerante a factores bióticos o abióticos. El cultivo requiere agua abundante y en Nicaragua la época lluviosa no es suficiente para cumplir con las necesidades hídricas (1.800-2.500 mm año-1). Las radiaciones gamma constituyen una herramienta para acelerar los programas de mejoramiento genético. En este estudio se evaluó el efecto de la irradiación con rayos gamma, como fuente de inducción de mutaciones en la exomorfología de dos cultivares de malanga. Plantas in vitro de malanga Lila y Blanca se irradiaron con 0 (testigo), 5, 10, 15, 20, 25 y 30 Gy de rayos gamma. Se evaluó altura de planta (cm), número de hojas, número de brotes, número de raíces, porcentaje de sobrevivencia, dosis de reducción de crecimiento en 50% [DR50] y dosis letal 50% [DL50]. En ambos cultivares las variables mostraron una correlación negativa con las dosis de irradiación; a medida que las dosis aumentaron, la altura de planta, el número de hojas, brotes y raíces disminuyó. La dosis de irradiación óptima en malanga Lila fueron 10, 13 y 16 Gy, en malanga Blanca fueron 20, 25 y 30 Gy. El 100% de sobrevivencia en malanga Blanca se registró en el testigo y las dosis 5 y 10 Gy; y en malanga Lila en el testigo y la dosis 5 Gy. La DL50 en malanga Lila fue de 19 Gy y en malanga Blanca la DL50 fue de 53 Gy.
Detalles del artículo

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial 4.0.
Los autores que publican en Siembra conocen y aceptan las siguientes condiciones:
- Los autores retienen los derechos de copia (copyright) y ceden a Siembra el derecho de primera publicación del trabajo, bajo licencia Creative Commons Attribution License, que permite a terceros utilizar lo publicado siempre que hagan referencia al autor o autores del trabajo y a su publicación en esta revista.
![]() Esta obra está bajo una Licencia Creative Commons Reconocimiento-NoComercial 4.0 Internacional (CC BY-NC 4.0).
Esta obra está bajo una Licencia Creative Commons Reconocimiento-NoComercial 4.0 Internacional (CC BY-NC 4.0).
- Los autores conservan los derechos de autor y garantizan a Siembra el derecho de publicar el manuscrito a través de los canales que considere adecuados.
- Los autores pueden establecer por su cuenta acuerdos adicionales para la distribución no exclusiva de la versión de la obra publicada en Siembra, haciendo reconocimiento de su publicación inicial en la misma, como por ejemplo en repositorios institucionales.
Se autoriza a los autores a difundir sus trabajos electrónicamente una vez sea aceptado el manuscrito para su publicación.
Citas
Ángeles-Espino, A., Valencia-Botín, A. J., Virgen-Calleros, G., Ramírez-Serrano, C., Paredes-Gutiérrez, L., y Hurtado-De la Peña, S. (2013). Determinación de la dosis letal (DL50) con Co60 en vitroplántulas de Agave tequilana var. Azul. Fitotecnia Mexicana, 36(4), 381-386. https://revistafitotecniamexicana.org/documentos/36-4/2a.pdf DOI: https://doi.org/10.35196/rfm.2013.4.381
Antúnez-Ocampo, O. M., Cruz-Izquierdo, S., Sandoval-Villa, M., Santacruz-Varela, A., Mendoza-Onofre, L. E., de la Cruz-Torres, E., y Peña-Lomelí, A. (2017). Variabilidad inducida en caracte-res fisiológicos de Physalis peruviana L. mediante rayos gamma 60Co aplicados a la semilla. Revista Fitotecnia Mexicana, 40(2), 211-218. https://doi.org/10.35196/rfm.2017.2.211-218 DOI: https://doi.org/10.35196/rfm.2017.2.211-218
Babaei, A. (2010). Genetic Diversity Analysis of Nemat Rice Mutant (Oryza sativa L.) Via RAPD Marker. American-Eurasian Journal of Agricultural & Environmental Sciences, 8(4), 452-456. https://idosi.org/aejaes/aejaes8(4).htm
Enríquez Juárez, D. Y., y Mairena Úbeda, E. N. (2011). Efecto de dos condiciones de humedad del suelo y tiempo de cosecha sobre el rendimiento de malanga (Colocasia esculenta L. Schott) para exportación Boaco - Nicaragua 2011. Universidad Nacional Agraria. https://repositorio.una.edu.ni/id/eprint/2140
Estrada Basaldúa, J. A., Pedraza Santos, M. E., De la Cruz Torres, E., Martínez Palacios, A., Sáenz Romero, C., y Morales García, J. L. (2011). Efecto de rayos gamma 60CO en nardo (Po-lianthes Tuberosa L.). Revista Mexicana de Ciencias Agrícolas, 2(spe3), 445-458. http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S2007-09342011000900004&lng=es&tlng=es
Fuchs, M., González, V., Castroni, S., Díaz, E., y Castro, L. (2002). Efecto de la radiación gamma sobre la diferenciación de plantas de caña de azúcar a partir de callos. Agronomía Tropical, 52(3), 311-324. http://ve.scielo.org/scielo.php?script=sci_arttext&pid=S0002-192X2002000300004&lng=es&tlng=es
García Rodríguez, L., Bermúdez Caraballoso, I., Orellana Pérez, P., Veitía Rodríguez, N., García Rodríguez, L., Clavero García, J., Romero Quintana, C. (2000). Inducción de mutaciones por radiaciones Gamma en el cultivo in vitro de brotes del cultivar Gran Enano (AAA). Biotecnolo-gía Vegetal, 1, 45-50. https://biblat.unam.mx/es/revista/biotecnologia-vegetal/articulo/induccion-de-mutaciones-por-radiaciones-gamma-en-el-cultivo-in-vitro-de-brotes-del-cultivar-gran-enano-aaa
González Oramas, G., Alemán García, S., Garriga, M., Ortíz, R., y de la Fe, C. (2007). Radiosen-sibilidad a rayos gamma (60Co) en brotes de henequén. Biotecnología Vegetal, 7(2), 115-117. https://revista.ibp.co.cu/index.php/BV/article/view/365
Hernández-Muñoz, S., Pedraza-Santos, M. E., López, P. A., De La Cruz-Torres, E., Fernández-Pavía, S. E., Martínez-Palacios, A., y Martínez-Trujillo, M. (2017). Determinación de la DL50 y GR50 con rayos gamma (60Co) en protocormos de Laelia autumnalis in vitro. Agrociencia, 51(5), 507-524. https://agrociencia-colpos.org/index.php/agrociencia/article/view/1307
Ilyas, S., y Naz, S. (2014). Effect of Gamma irradiation on morphological characteristics and isola-tion of curcuminoids and oleoresins of cúrcuma longa L. The Journal of Animal & Plant Scienc-es, 24(5), 1396-1404. https://www.thejaps.org.pk/docs/v-24-5/18.pdf
Latado, R. R. (1993). Inducao e uso de mutacoes “in vitro” no melhoramento do Chrysanthemum morifolium Ram. Universidade de Sao Paulo. https://teses.usp.br/teses/disponiveis/11/11137/tde-20220208-032802/
López Zada, M., Vázquez Becalli, E., y López Fleites, R. (1984). Raíces y Tubérculos. Pueblo y Educación.
Lozada Barrera, A. F. (2005). Producción del cultivo de papa china (Colocasia esculenta) utilizan-do dos métodos de propagación asexual bajo cuatro niveles de fertilización orgánica. Universi-dad de las Fuerzas Armadas - ESPE. https://repositorio.espe.edu.ec/bitstream/21000/5423/4/T-ESPE-IASA%20I-002856.pdf
Martirena-Ramírez, A., Veitía, N., García, L. R., Collado, R., Torres, D., Rivero, L., y Ramírez-López, M. (2018). Dosis óptima de radiaciones Gamma para la regeneración de plantas in vitro de Phaseolus vulgaris L. cultivar ‘BAT-93’. Biotecnología Vegetal, 18(1), 21-32. https://revista.ibp.co.cu/index.php/BV/article/view/572
Medero Vega, V. R., López Torres, J., Ventura Martín, J. de la C., Basail Pérez, M., Rayas Cabre-ra, A., Santos Pino, A., Beovides García, Y., Rodríguez Pérez, D., Torres Delgado, M., y Bravo Corrales, Y.(2014). Determinación de la dosis letal media in vitro para la inducción de mutacio-nes en malanga Colocasia. En XIX Congreso Científico Internacional: VIII Simposio de Mejo-ramiento y Conservación de Recursos Fitogenéticos. Cuba. http://ediciones.inca.edu.cu/files/congresos/2014/CD/memorias/ponencias/talleres/MCF/ra/MCF-O.19.pdf
Mukhtar Ali Ghanim, A., Spencer, M. M., y Thomas, W. (2021). Mejoramiento por mutaciones de cultivos propagados por semillas: selección parental, desarrollo de generaciones mutan-tes, detección de mutaciones, evaluación de mutantes y factores que influyen en el éxito. En M. M. Spencer-Lopes, B. P. Forster, y L. Jankuloski (coords.), Manual de mejoramiento por mutaciones (3ª ed.) (pp. 99-128). FAO y OIEA. https://doi.org/10.4060/i9285es
Nurilmala, F., Hutagaol, R. P., Widhyastini, I. M., Widyastuti, U., y Suharsono, S. (2017). Somaclonal variation induction of Bogor taro (Colocasia esculenta) by gamma irradiation. Bio-diversitas Journal of Biological Diversity, 18(1), 28-33. https://doi.org/10.13057/biodiv/d180105 DOI: https://doi.org/10.13057/biodiv/d180105
Otahola Gómez, V., Aray, M., y Antoima, Y. (2001). Inducción de mutantes para el color de la flor en crisantemos (Dendrathema grandiflora (Ram.) Tzvelev) mediante radiaciones gamma. UDO Agrícola, 1(1), 56-63. http://saber.udo.edu.ve/index.php/udoagricola/article/view/3434
Pérez Ponce, J. N. (1998). Propagación y mejora genética de plantas por biotecnología. Instituto de Biotecnología de las Plantas.
Ramírez, D., Ordaz, J. L., Mora, J., Acosta, A., y Serna B. (2010). Nicaragua efectos del cambio climático sobre la agricultura. CEPAL. https://hdl.handle.net/11362/25925
Robles Sánchez, R. (1986). Genética elemental y fitomejoramiento práctico (1a ed.). Limusa.
Sahoo, B. B., Kole, P. C., y Sahoo, M. R. (2015). Effects of γ irradiation on leaf blight disease of some taro (Colocasia esculenta L. Schott) genotypes. International Journal of Bio-resource and Stress Management, 6(1), 7-14. https://ojs.pphouse.org/index.php/IJBSM/article/view/641 DOI: https://doi.org/10.5958/0976-4038.2015.00002.0
Sarsu, F., Penna, S., Kunter, B., e Ibrahim, R. (2021a). Mejoramiento por mutaciones de cultivos propagados vegetativamente. En M. M. Spencer-Lopes, B. P. Forster, y L. Jankuloski (coords.), Manual de mejoramiento por mutaciones (3ª ed.) (pp. 131-144). FAO y OIEA. https://doi.org/10.4060/i9285es
Sarsu, F., Spencer-Lopes, M. M., Sangwan, R., y Penna, S. (2021b). Técnicas específicas para aumentar la eficiencia del mejoramiento por mutaciones: Métodos in vitro en el cambio del mejoramiento de plantas por mutación. En M. M. Spencer-Lopes, B. P. Forster, y L. Janku-loski (coords.), Manual de mejoramiento por mutaciones (3ª ed.) (pp. 171-186). FAO y OIEA. https://doi.org/10.4060/i9285es
Seetohul, S., Puchooa, D., y Ranghoo-Sanmukhiya, V. M. (2008). Genetic Improvement of Taro (Colocasia esculenta var esculenta) through in-vitro mutagenesis. University of Mauritius Research Journal, 13A, 79-89. https://www.ajol.info/index.php/umrj/article/view/130901
Spencer-Lopes, M. M., Jankuloski, L., Mukhtar Ali Ghanim, A., Matijevic, M., y Kodym, A. (2021). Mutagénesis física. En M. M. Spencer-Lopes, B. P. Forster, y L. Jankuloski (coords.), Ma-nual de mejoramiento por mutaciones (3ª ed.) (pp. 5-41). FAO y OIEA. https://doi.org/10.4060/i9285es DOI: https://doi.org/10.4060/i9285es
Valdez Balero, A., Orellana Pérez, P., Veitía Rodríguez, N., y Torres Rodríguez, D. (2004). Creci-miento, regeneración y radiosensibilidad de callos de caña de azúcar (Saccharum spp. hibrido var. “SP 70-1284”) tratados con radiación gamma fuente 60CO. Biotecnología Vegetal, 4(3), 165-169. https://revista.ibp.co.cu/index.php/BV/article/view/419
Vasudevan, K., y Jos, J. S. (1990). Methods to enhance solid mutation frequency in Colocasia. Current Science, 59(4), 226-227. http://www.jstor.org/stable/24094796
Veitía, N., García, L., Bermúdez-Caraballoso, I., Orellana, P., Padrón, Y., y Torres, D. (2007). Efecto de las radiaciones gamma sobre callos de papa var. ‘Desirée’. Biotecnología Vegetal, 7(1), 57-61. https://revista.ibp.co.cu/index.php/BV/article/view/358