Effect of gamma ray on the morphology of two in vitro taro cultivars (Colocasia esculenta L. Schott)
Main Article Content
Abstract
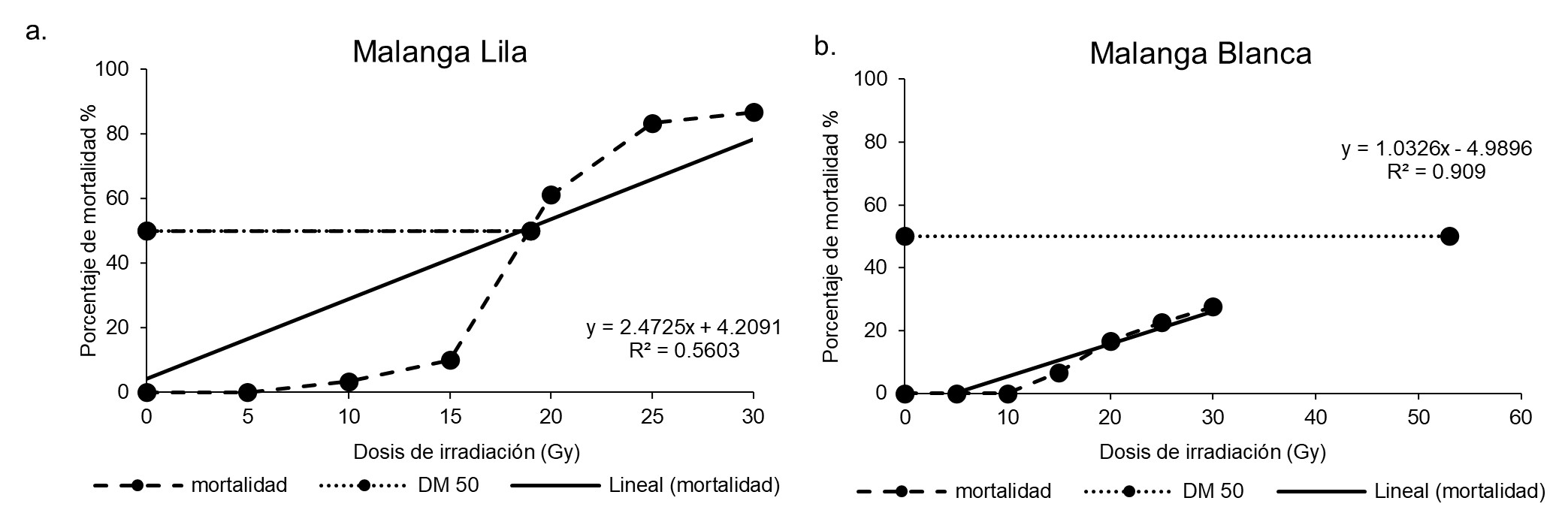
In Nicaragua, two taro cultivars (Lila and Blanca) (Colocasia esculenta L. Schott) are cultivated, yet neither cultivar exhibits tolerance to biotic or abiotic factors. The crop requires abundant water, and in Nicaragua the rainy season is insufficient to meet water requirements for this crop. Gamma radiation has been identified as a tool to accelerate plant breeding programs. The present study evaluated the effect of gamma ray irradiation as a source of mutation induction in the morphology of two taro cultivars. In vitro plants of Lila and Blanca taro were irradiated with 0 (control), 5, 10, 15, 20, 25 and 30 Gy of gamma rays. The variables evaluated were plant height (cm), leaf number, shoot number, root number, survival percentage, 50% growth reduction dose [DR50] and 50% lethal dose [DL50]. In both cultivars the variables presented a negative correlation with the irradiation doses; as the doses increased, plant height, number of leaves, shoots and roots decreased. The optimal irradiation doses for Lila taro were determined to be 10, 13 and 16 Gy, while for Blanca taro these doses were 20, 25 and 30 Gy. In the case of Blanca taro, 100% survival was recorded in the control and at the 5 and 10 Gy doses. In the case of Lila taro, 100% survival was recorded in the control and at the 5 Gy dose. The LD50 in Lila taro was determined to be 19 Gy, while in Blanca taro, the LD50 was established as 53 Gy.
Downloads
Metrics
Article Details

This work is licensed under a Creative Commons Attribution-NonCommercial 4.0 International License.
The authors who publish in Siembra know and accept the following conditions:
- Authors retain the copyright and grant Siembra the right of first publication of the work, under the Creative Commons Attribution License. Third parties are allowed to use what has been published as long as they refer to the author or authors of the work and its publication in this journal.
![]() This content is licensed under a Creative Commons Attribution-Noncommercial 4.0 International (CC BY-NC 4.0).
This content is licensed under a Creative Commons Attribution-Noncommercial 4.0 International (CC BY-NC 4.0).
- Authors maintain the copyright and guarantee Siembra the right to publish the manuscript through the channels it considers appropriate.
- Authors may establish on their own additional agreements for the non-exclusive distribution of the version of the work published in Siembra, acknowledging their initial publication in the same, such as in institutional repositories.
- Authors are authorized to disseminate their work electronically once the manuscript is accepted for publication.
References
Ángeles-Espino, A., Valencia-Botín, A. J., Virgen-Calleros, G., Ramírez-Serrano, C., Paredes-Gutiérrez, L., y Hurtado-De la Peña, S. (2013). Determinación de la dosis letal (DL50) con Co60 en vitroplántulas de Agave tequilana var. Azul. Fitotecnia Mexicana, 36(4), 381-386. https://revistafitotecniamexicana.org/documentos/36-4/2a.pdf DOI: https://doi.org/10.35196/rfm.2013.4.381
Antúnez-Ocampo, O. M., Cruz-Izquierdo, S., Sandoval-Villa, M., Santacruz-Varela, A., Mendoza-Onofre, L. E., de la Cruz-Torres, E., y Peña-Lomelí, A. (2017). Variabilidad inducida en caracte-res fisiológicos de Physalis peruviana L. mediante rayos gamma 60Co aplicados a la semilla. Revista Fitotecnia Mexicana, 40(2), 211-218. https://doi.org/10.35196/rfm.2017.2.211-218 DOI: https://doi.org/10.35196/rfm.2017.2.211-218
Babaei, A. (2010). Genetic Diversity Analysis of Nemat Rice Mutant (Oryza sativa L.) Via RAPD Marker. American-Eurasian Journal of Agricultural & Environmental Sciences, 8(4), 452-456. https://idosi.org/aejaes/aejaes8(4).htm
Enríquez Juárez, D. Y., y Mairena Úbeda, E. N. (2011). Efecto de dos condiciones de humedad del suelo y tiempo de cosecha sobre el rendimiento de malanga (Colocasia esculenta L. Schott) para exportación Boaco - Nicaragua 2011. Universidad Nacional Agraria. https://repositorio.una.edu.ni/id/eprint/2140
Estrada Basaldúa, J. A., Pedraza Santos, M. E., De la Cruz Torres, E., Martínez Palacios, A., Sáenz Romero, C., y Morales García, J. L. (2011). Efecto de rayos gamma 60CO en nardo (Po-lianthes Tuberosa L.). Revista Mexicana de Ciencias Agrícolas, 2(spe3), 445-458. http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S2007-09342011000900004&lng=es&tlng=es
Fuchs, M., González, V., Castroni, S., Díaz, E., y Castro, L. (2002). Efecto de la radiación gamma sobre la diferenciación de plantas de caña de azúcar a partir de callos. Agronomía Tropical, 52(3), 311-324. http://ve.scielo.org/scielo.php?script=sci_arttext&pid=S0002-192X2002000300004&lng=es&tlng=es
García Rodríguez, L., Bermúdez Caraballoso, I., Orellana Pérez, P., Veitía Rodríguez, N., García Rodríguez, L., Clavero García, J., Romero Quintana, C. (2000). Inducción de mutaciones por radiaciones Gamma en el cultivo in vitro de brotes del cultivar Gran Enano (AAA). Biotecnolo-gía Vegetal, 1, 45-50. https://biblat.unam.mx/es/revista/biotecnologia-vegetal/articulo/induccion-de-mutaciones-por-radiaciones-gamma-en-el-cultivo-in-vitro-de-brotes-del-cultivar-gran-enano-aaa
González Oramas, G., Alemán García, S., Garriga, M., Ortíz, R., y de la Fe, C. (2007). Radiosen-sibilidad a rayos gamma (60Co) en brotes de henequén. Biotecnología Vegetal, 7(2), 115-117. https://revista.ibp.co.cu/index.php/BV/article/view/365
Hernández-Muñoz, S., Pedraza-Santos, M. E., López, P. A., De La Cruz-Torres, E., Fernández-Pavía, S. E., Martínez-Palacios, A., y Martínez-Trujillo, M. (2017). Determinación de la DL50 y GR50 con rayos gamma (60Co) en protocormos de Laelia autumnalis in vitro. Agrociencia, 51(5), 507-524. https://agrociencia-colpos.org/index.php/agrociencia/article/view/1307
Ilyas, S., y Naz, S. (2014). Effect of Gamma irradiation on morphological characteristics and isola-tion of curcuminoids and oleoresins of cúrcuma longa L. The Journal of Animal & Plant Scienc-es, 24(5), 1396-1404. https://www.thejaps.org.pk/docs/v-24-5/18.pdf
Latado, R. R. (1993). Inducao e uso de mutacoes “in vitro” no melhoramento do Chrysanthemum morifolium Ram. Universidade de Sao Paulo. https://teses.usp.br/teses/disponiveis/11/11137/tde-20220208-032802/
López Zada, M., Vázquez Becalli, E., y López Fleites, R. (1984). Raíces y Tubérculos. Pueblo y Educación.
Lozada Barrera, A. F. (2005). Producción del cultivo de papa china (Colocasia esculenta) utilizan-do dos métodos de propagación asexual bajo cuatro niveles de fertilización orgánica. Universi-dad de las Fuerzas Armadas - ESPE. https://repositorio.espe.edu.ec/bitstream/21000/5423/4/T-ESPE-IASA%20I-002856.pdf
Martirena-Ramírez, A., Veitía, N., García, L. R., Collado, R., Torres, D., Rivero, L., y Ramírez-López, M. (2018). Dosis óptima de radiaciones Gamma para la regeneración de plantas in vitro de Phaseolus vulgaris L. cultivar ‘BAT-93’. Biotecnología Vegetal, 18(1), 21-32. https://revista.ibp.co.cu/index.php/BV/article/view/572
Medero Vega, V. R., López Torres, J., Ventura Martín, J. de la C., Basail Pérez, M., Rayas Cabre-ra, A., Santos Pino, A., Beovides García, Y., Rodríguez Pérez, D., Torres Delgado, M., y Bravo Corrales, Y.(2014). Determinación de la dosis letal media in vitro para la inducción de mutacio-nes en malanga Colocasia. En XIX Congreso Científico Internacional: VIII Simposio de Mejo-ramiento y Conservación de Recursos Fitogenéticos. Cuba. http://ediciones.inca.edu.cu/files/congresos/2014/CD/memorias/ponencias/talleres/MCF/ra/MCF-O.19.pdf
Mukhtar Ali Ghanim, A., Spencer, M. M., y Thomas, W. (2021). Mejoramiento por mutaciones de cultivos propagados por semillas: selección parental, desarrollo de generaciones mutan-tes, detección de mutaciones, evaluación de mutantes y factores que influyen en el éxito. En M. M. Spencer-Lopes, B. P. Forster, y L. Jankuloski (coords.), Manual de mejoramiento por mutaciones (3ª ed.) (pp. 99-128). FAO y OIEA. https://doi.org/10.4060/i9285es
Nurilmala, F., Hutagaol, R. P., Widhyastini, I. M., Widyastuti, U., y Suharsono, S. (2017). Somaclonal variation induction of Bogor taro (Colocasia esculenta) by gamma irradiation. Bio-diversitas Journal of Biological Diversity, 18(1), 28-33. https://doi.org/10.13057/biodiv/d180105 DOI: https://doi.org/10.13057/biodiv/d180105
Otahola Gómez, V., Aray, M., y Antoima, Y. (2001). Inducción de mutantes para el color de la flor en crisantemos (Dendrathema grandiflora (Ram.) Tzvelev) mediante radiaciones gamma. UDO Agrícola, 1(1), 56-63. http://saber.udo.edu.ve/index.php/udoagricola/article/view/3434
Pérez Ponce, J. N. (1998). Propagación y mejora genética de plantas por biotecnología. Instituto de Biotecnología de las Plantas.
Ramírez, D., Ordaz, J. L., Mora, J., Acosta, A., y Serna B. (2010). Nicaragua efectos del cambio climático sobre la agricultura. CEPAL. https://hdl.handle.net/11362/25925
Robles Sánchez, R. (1986). Genética elemental y fitomejoramiento práctico (1a ed.). Limusa.
Sahoo, B. B., Kole, P. C., y Sahoo, M. R. (2015). Effects of γ irradiation on leaf blight disease of some taro (Colocasia esculenta L. Schott) genotypes. International Journal of Bio-resource and Stress Management, 6(1), 7-14. https://ojs.pphouse.org/index.php/IJBSM/article/view/641 DOI: https://doi.org/10.5958/0976-4038.2015.00002.0
Sarsu, F., Penna, S., Kunter, B., e Ibrahim, R. (2021a). Mejoramiento por mutaciones de cultivos propagados vegetativamente. En M. M. Spencer-Lopes, B. P. Forster, y L. Jankuloski (coords.), Manual de mejoramiento por mutaciones (3ª ed.) (pp. 131-144). FAO y OIEA. https://doi.org/10.4060/i9285es
Sarsu, F., Spencer-Lopes, M. M., Sangwan, R., y Penna, S. (2021b). Técnicas específicas para aumentar la eficiencia del mejoramiento por mutaciones: Métodos in vitro en el cambio del mejoramiento de plantas por mutación. En M. M. Spencer-Lopes, B. P. Forster, y L. Janku-loski (coords.), Manual de mejoramiento por mutaciones (3ª ed.) (pp. 171-186). FAO y OIEA. https://doi.org/10.4060/i9285es
Seetohul, S., Puchooa, D., y Ranghoo-Sanmukhiya, V. M. (2008). Genetic Improvement of Taro (Colocasia esculenta var esculenta) through in-vitro mutagenesis. University of Mauritius Research Journal, 13A, 79-89. https://www.ajol.info/index.php/umrj/article/view/130901
Spencer-Lopes, M. M., Jankuloski, L., Mukhtar Ali Ghanim, A., Matijevic, M., y Kodym, A. (2021). Mutagénesis física. En M. M. Spencer-Lopes, B. P. Forster, y L. Jankuloski (coords.), Ma-nual de mejoramiento por mutaciones (3ª ed.) (pp. 5-41). FAO y OIEA. https://doi.org/10.4060/i9285es DOI: https://doi.org/10.4060/i9285es
Valdez Balero, A., Orellana Pérez, P., Veitía Rodríguez, N., y Torres Rodríguez, D. (2004). Creci-miento, regeneración y radiosensibilidad de callos de caña de azúcar (Saccharum spp. hibrido var. “SP 70-1284”) tratados con radiación gamma fuente 60CO. Biotecnología Vegetal, 4(3), 165-169. https://revista.ibp.co.cu/index.php/BV/article/view/419
Vasudevan, K., y Jos, J. S. (1990). Methods to enhance solid mutation frequency in Colocasia. Current Science, 59(4), 226-227. http://www.jstor.org/stable/24094796
Veitía, N., García, L., Bermúdez-Caraballoso, I., Orellana, P., Padrón, Y., y Torres, D. (2007). Efecto de las radiaciones gamma sobre callos de papa var. ‘Desirée’. Biotecnología Vegetal, 7(1), 57-61. https://revista.ibp.co.cu/index.php/BV/article/view/358