Parámetros adecuados para la evaluación de germinación de cepas élite de hongos biocontroladores
Contenido principal del artículo
Resumen
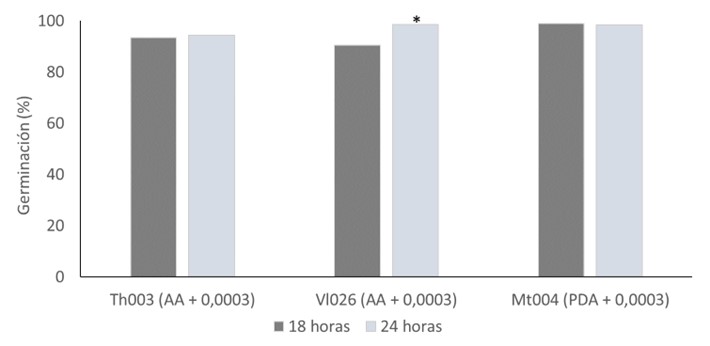
La comercialización de plaguicidas microbianos ha aumentado de manera exponencial en los últimos años. Casi el 70 % de los productos que se comercializan utilizan como principio activo conidios de hongos biocontroladores y uno de los criterios más utilizados para evaluar la calidad de estos productos es la prueba de germinación de conidios. Específicamente, se utiliza para la selección y la evaluación de la viabilidad y vigor de cepas élite con potencial biológico. Algunos de los factores que influyen en la germinación de los conidios incluye la selección del medio del cultivo, la temperatura, el tiempo de incubación y la adición de sustancias sincronizadoras de germinación. La optimización para cada cepa élite permite estimar el comportamiento del microorganismo, lo que garantizará su actividad biológica y eficacia, al ser un recurso biológico con fines comerciales. El objetivo de este trabajo fue seleccionar las condiciones óptimas (medios de cultivo, tiempo de incubación y concentración de sustancia sincronizadora) para la germinación de tres cepas élite Trichoderma koningiopsis (Th003), Lecanicillium lecanii (Vl026) y Metarhizium robertsii (Mt004), las cuales son principios activos de bioplaguicidas en proceso de comercialización. Como resultado se seleccionó el medio de cultivo de agar agua con benomil al 0,0003 % con un tiempo de lectura de 18 h para Th003 y de 24 h para Vl026. Para la cepa Mt004, el medio de cultivo que favoreció la germinación sincrónica de los conidios fue agar PDA suplementado con benomil al 0,0003 % con un tiempo de lectura de 18 h. Estas condiciones permitirán a través del tiempo realizar una correcta evaluación de la germinación de los agentes de control biológico y garantizar su viabilidad y vigor como principio activo de bioplaguicidas.
Descargas
Métricas
Detalles del artículo

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial 4.0.
Los autores que publican en Siembra conocen y aceptan las siguientes condiciones:
- Los autores retienen los derechos de copia (copyright) y ceden a Siembra el derecho de primera publicación del trabajo, bajo licencia Creative Commons Attribution License, que permite a terceros utilizar lo publicado siempre que hagan referencia al autor o autores del trabajo y a su publicación en esta revista.
![]() Esta obra está bajo una Licencia Creative Commons Reconocimiento-NoComercial 4.0 Internacional (CC BY-NC 4.0).
Esta obra está bajo una Licencia Creative Commons Reconocimiento-NoComercial 4.0 Internacional (CC BY-NC 4.0).
- Los autores conservan los derechos de autor y garantizan a Siembra el derecho de publicar el manuscrito a través de los canales que considere adecuados.
- Los autores pueden establecer por su cuenta acuerdos adicionales para la distribución no exclusiva de la versión de la obra publicada en Siembra, haciendo reconocimiento de su publicación inicial en la misma, como por ejemplo en repositorios institucionales.
Se autoriza a los autores a difundir sus trabajos electrónicamente una vez sea aceptado el manuscrito para su publicación.
Citas
Afifah, L., Desriana, R., Kurniati, A., y Maryana, R. (2020). Viability of entomopathogenic fungi Metarhizium anisopliae (Metsch) Sorokin in some alternative media and different shelf-life. International Journal of Agriculture System, 8(2),108-118. http://dx.doi.org/10.20956/ijas.v8i2.2478
Alves, S. B., Pereira, R. M., Stimac, J. L., y Vieira, S. A. (1996). Delayed germination of Beauveria bassiana conidia after prolonged storage at low, above-freezing temperatures. Biocontrol Science and Technology, 6(4), 575-582. https://doi.org/10.1080/09583159631217 DOI: https://doi.org/10.1080/09583159631217
Brunner-Mendoza, C., Reyes-Montes, M. del R., Moonjely, S., Bidochka, M. J., y Toriello, C. (2019). A review on the genus Metarhizium as an entomopathogenic microbial biocontrol agent with emphasis on its use and utility in Mexico. Biocontrol Science and Technology, 29(1), 83-102. https://doi.org/10.1080/09583157.2018.1531111 DOI: https://doi.org/10.1080/09583157.2018.1531111
Castellanos González, L., Monroy Gonzalez, H. H., y Rivera Ochoa, X. G. (2022). Wilting by Fusarium oxysporum Schlthl in masaguaro (Pseudosamanea guachapele) (Kunth). INGE CUC, 19(1), 11-21. https://doi.org/10.17981/ingecuc.19.1.2023.02 DOI: https://doi.org/10.17981/ingecuc.19.1.2023.02
Cotes Prado, A. M. (ed.). (2018). Control biológico de fitopatógenos, insectos y ácaros: aplicaciones y perspectivas. Vol. 2. Agrosavia. https://doi.org/10.21930/agrosavia.investigation.7402544 DOI: https://doi.org/10.21930/agrosavia.investigation.7402544
Daryaei, A., Jones, E. E., Glare, T. R., y Falloon, R. E. (2016). Biological fitness of Trichoderma atroviride during long-term storage, after production in different culture conditions. Biocontrol Science and Technology, 26(1), 86-103. https://doi.org/10.1080/09583157.2015.1077929 DOI: https://doi.org/10.1080/09583157.2015.1077929
Diego-Nava, F., Granados-Echegoyen, C., Ruíz-Vega, J., Aquino-Bolaños, T., Pérez-Pacheco, R., Díaz-Ramos, A., Alonso-Hernández, N., Arroyo-Balán, F., y López-Hernández, M. B. (2023). Functional and quality assessment of a spore harvester for entomopathogenic fungi for biopesticide production. AgriEngineering, 5(2), 801-813. https://doi.org/10.3390/agriengineering5020049 DOI: https://doi.org/10.3390/agriengineering5020049
Faria, M. R. de, y Wraight, S. P. (2007). Mycoinsecticides and Mycoacaricides: A comprehensive list with worldwide coverage and international classification of formulation types. Biological Control, 43(3), 237-256. https://doi.org/10.1016/j.biocontrol.2007.08.001 DOI: https://doi.org/10.1016/j.biocontrol.2007.08.001
Faria, M., Hotchkiss, J. H., Hajek, A. E., y Wraight, S. P. (2010). Debilitation in conidia of the entomopathogenic fungi Beauveria bassiana and Metarhizium anisopliae and implication with respect to viability determinations and mycopesticide quality assessments. Journal of Invertebrate Pathology, 105(1), 74-83. https://doi.org/10.1016/j.jip.2010.05.011 DOI: https://doi.org/10.1016/j.jip.2010.05.011
Francisco, E. A., Mochi, D. A., Correia, A. do C. B., y Monteiro, A. C. (2006). Influence of culture media in viability test of conidia of entomopathogenic fungi. Ciência Rural, 36(4), 1309-1312. https://doi.org/10.1590/S0103-84782006000400043 DOI: https://doi.org/10.1590/S0103-84782006000400043
Gilchrist, M. A., Sulsky, D. L., y Pringle, A. (2006). Identifying fitness and optimal life‐history strategies for an asexual filamentous fungus. Evolution, 60(5), 970-979. https://doi.org/10.1111/j.0014-3820.2006.tb01175.x DOI: https://doi.org/10.1111/j.0014-3820.2006.tb01175.x
Hsia, I. C. C., Islam, M. T., Ibrahim, Y., Howand, T.Y., Omar, D. (2014). Evaluation of conidial viability of entomopathogenic fungi as influenced by temperature and additive. International Journal of Agriculture & Biology, 16(1), 146-152. https://www.fspublishers.org/Issue.php?categoryID=122
Inglis, G. D., Enkerli, J., y Goettel, M. S. (2012). Laboratory techniques used for entomopathogenic fungi: Hypocreales. En L. A. Lacey (ed.), Manual of Techniques in Invertebrate Pathology (2nd ed.) (pp. 189-253). Elsevier. https://doi.org/10.1016/B978-0-12-386899-2.00007-5 DOI: https://doi.org/10.1016/B978-0-12-386899-2.00007-5
Jackson, M. A. (1997). Optimizing nutritional conditions for the liquid culture production of effective fungal biological control agents. Journal of Industrial Microbiology and Biotechnology, 19, 180-187. https://doi.org/10.1038/sj.jim.2900426 DOI: https://doi.org/10.1038/sj.jim.2900426
Kala, S., Sogan, N., Agarwal, A., Naik, S. N., Patanjali, P. K., y Kumar, J. (2020). Biopesticides: formulations and delivery techniques. En C. Egbuna, y B. Sawicka (eds.), Natural remedies for pest, disease and weed control (pp. 209-220). Elsevier. https://doi.org/10.1016/B978-0-12-819304-4.00018-X DOI: https://doi.org/10.1016/B978-0-12-819304-4.00018-X
Le Grand, M., y Cliquet, S. (2013). Impact of culture age on conidial germination, desiccation and UV tolerance of entomopathogenic fungi. Biocontrol Science and Technology, 23(7), 847-859. https://doi.org/10.1080/09583157.2013.802289 DOI: https://doi.org/10.1080/09583157.2013.802289
Lopes, R. B., y Faria, M. (2019). Influence of two formulation types and moisture levels on the storage stability and insecticidal activity of Beauveria bassiana. Biocontrol Science and Technology, 29(5), 437-450. https://doi.org/10.1080/09583157.2019.1566436 DOI: https://doi.org/10.1080/09583157.2019.1566436
McGuire, A. v., y Northfield, T. D. (2020). Tropical occurrence and agricultural importance of Beauveria bassiana and Metarhizium anisopliae. Frontiers in Sustainable Food Systems, 4, 6. https://doi.org/10.3389/fsufs.2020.00006 DOI: https://doi.org/10.3389/fsufs.2020.00006
Meirelles, L. N., Mesquita, E., Corrêa, T. A., Bitencourt, R. de O. B., Oliveira, J. L., Fraceto, L. F., Camargo, M. G., y Bittencourt, V. R. E. P. (2023). Encapsulation of entomopathogenic fungal conidia: evaluation of stability and control potential of Rhipicephalus microplus. Ticks and Tick-Borne Diseases, 14(4), 102184. https://doi.org/10.1016/j.ttbdis.2023.102184 DOI: https://doi.org/10.1016/j.ttbdis.2023.102184
Miranda-Hernández, F., Angel-Cuapio, A., y Loera-Corral, O. (2017). Production of Fungal Spores for Biological Control. En A. Pandey, S. Negi, y C. R. Soccol (eds.), Current Developments in Biotechnology and Bioengineering (pp. 757–779). Elsevier. https://doi.org/10.1016/B978-0-444-63662-1.00033-6 DOI: https://doi.org/10.1016/B978-0-444-63662-1.00033-6
Mukhopadhyay, R., y Kumar, D. (2020). Trichoderma: a beneficial antifungal agent and insights into its mechanism of biocontrol potential. Egyptian Journal of Biological Pest Control, 30, 133. https://doi.org/10.1186/s41938-020-00333-x DOI: https://doi.org/10.1186/s41938-020-00333-x
Oliveira, D. G. P., Pauli, G., Mascarin, G. M., y Delalibera, I. (2015). A protocol for determination of conidial viability of the fungal entomopathogens Beauveria bassiana and Metarhizium anisopliae from commercial products. Journal of Microbiological Methods, 119, 44-52. https://doi.org/10.1016/j.mimet.2015.09.021 DOI: https://doi.org/10.1016/j.mimet.2015.09.021
Pathan, E. K., Patil, A. V., & Deshpande, M. V. (2019). Bioprospecting of fungal entomo-and myco-pathogens. En T. Satyanarayana, S. K. Deshmukh, y M. V. Deshpande (eds.), Advancing Frontiers in Mycology & Mycotechnology: Basic and Applied Aspects of Fungi (pp. 497-513). Springer Nature eBookhttps://doi.org/10.1007/978-981-13-9349-5_20 DOI: https://doi.org/10.1007/978-981-13-9349-5_20
Permadi, M. A., Mukhlis, Samosir, B. S., Siregar, D. Y., y Wayni, M. (2020). Physiology characterization of entomopathogenic fungi Beauveria bassiana and Metarhizium anisopliae on different carbohydrate sources. Journal of Physics: Conference Series, 1477(7), 072007. https://doi.org/10.1088/1742-6596/1477/7/072007 DOI: https://doi.org/10.1088/1742-6596/1477/7/072007
Rangel, D. E. N., Braga, G. U. L., Anderson, A. J., y Roberts, D. W. (2005). Variability in conidial thermotolerance of Metarhizium anisopliae isolates from different geographic origins. Journal of Invertebrate Pathology, 88(2), 116-125. https://doi.org/10.1016/j.jip.2004.11.007 DOI: https://doi.org/10.1016/j.jip.2004.11.007
Rodríguez-León, J. A., Domenech, F., León, M., Méndez, T., Rodríguez, D. E., y Pandey, A. (1999). Production of spores of Trichoderma harzianum on sugar cane molasses and bagasse pith in solid state fermentation for biocontrol. Brazilian Archives of Biology and Technology, 42(1). https://doi.org/10.1590/S1516-89131999000100010 DOI: https://doi.org/10.1590/S1516-89131999000100010
Saldaña-Mendoza, S. A., Pacios-Michelena, S., Palacios-Ponce, A. S., Chávez-González, M. L., y Aguilar, C. N. (2023). Trichoderma as a biological control agent: mechanisms of action, benefits for crops and development of formulations. World Journal of Microbiology and Biotechnology, 39, 269.https://doi.org/10.1007/s11274-023-03695-0 DOI: https://doi.org/10.1007/s11274-023-03695-0
Santos Díaz, A. M., Grijalba Bernal, E. P., Torres Torres, L., y Uribe Gutiérrez, L. A. (2022). Plaguicidas microbianos: control y aseguramiento de calidad. Agrosavia. https://doi.org/10.21930/agrosavia.manual.7405125 DOI: https://doi.org/10.21930/agrosavia.manual.7405125
Stentelaire, C., Antoine, N., Cabrol, C., Feron, G., y Durand, A. (2001). Development of a rapid and highly sensitive biochemical method for the measurement of fungal spore viability. An alternative to the CFU method. Enzyme and Microbial Technology, 29, 560-566. https://doi.org/10.1016/S0141-0229(01)00432-X DOI: https://doi.org/10.1016/S0141-0229(01)00432-X
Yáñez, M., y France, A. 2010. Effects of fungicides on the development of the entomopathogenic fungus Metarhizium anisopliae var. anisopliae. Chilean Journal of Agricultural Research, 70(3), 390-398. http://dx.doi.org/10.4067/S0718-58392010000300006 DOI: https://doi.org/10.4067/S0718-58392010000300006
Zaki, O., Weekers, F., Thonart, P., Tesch, E., Kuenemann, P., y Jacques, P. (2020). Limiting factors of mycopesticide development. Biological Control, 144, 104220. https://doi.org/10.1016/j.biocontrol.2020.104220 DOI: https://doi.org/10.1016/j.biocontrol.2020.104220